LA RESPIRAZIONE MITOCONDRIALE
I mitocondri sono gli organuli responsabili della produzione di energia necessaria alla cellula per crescere e riprodursi. Queste reazioni, che nel loro insieme costituiscono il processo di “respirazione cellulare”, comportano il consumo di ossigeno e la produzione di anidride carbonica. Infatti il glucosio viene bruciato in presenza di ossigeno e l’energia liberata, immagazzinata sotto forma di ATP
Tutte le cellule hanno mitocondri. La maggior parte dei mitocondri è localizzata nella porzione della cellula che ha maggior richiesta energetica. Meno abbondanti in quelle cellule che lavorano in condizioni anaerobiche.
◦ NON TUTTI I MEDICI SI OCCUPANO, PRIMA DI OGNI INTERVENTO SULLA RIATTIVAZIONE DI UNA FUNZIONE ORGANICA, DI SEMPRE RIPORTARE LA PRODUZIONE DI ATP AL MASSIMO LIVELLO POSSIBILE
Nelle terapie che seguono la visita TLM il primo obiettivo che si pongono i nostri medici è quella di ripristinare la piena produzione di ATP, ovvero dell’energia della cellula. Senza questa condizione non è possibile spegnere le attivazione cerebrali, cause di malattia e causate dagli eventi più difficili che dobbiamo affrontare nella vita, cioè tutti quegli eventi che ci costringono ad evolverci (ovvero evolvere il nostro modo di pensare), pena la malattia e la morte…
Osservando in natura le piante più deboli che vengono sistematicamente attaccate da parassiti, gli animali più deboli che soccombono, sembra quasi che alla base del funzionamento di alcune leggi della Natura esistano dei meccanismi di selezione per cui chi non sappia evolversi, cioè non sappia rendersi utile all’evoluzione di questo pianeta, sia destinato ad uscire di scena… Madre natura quasi sempre ci dà un tempo limite per risolvere i nostri conflitti, dopodiché dovremo per forza affrontare quei processi che chiamiamo malattie… Spesso una malattia affrontata con l’intenzione di capire il perchè , ci porta ad una qualità della vita migliore. anche questa è la ragione per cui di fronte ad una malattia dovremmo piuttosto avere un atteggiamento di gratitudine anziché di rabbia.
L’acidosi (squilibrio acido basico), l’ipossia (carenza di ossigeno), squilibri nella polarità di membrana cellulare, il mancato funzionamento del sistema immunitario sono condizioni base di malattie come il cancro e sono anche meccanismi intimamente connessi al buon funzionamento dei mitocondri.
Le cellule muoiono quando i mitocondri non producono energia.
I mitocondri, dotati di un proprio DNA (mtDNA o DNA mitocondriale), sono organelli a doppia membrana presenti all’interno delle nostre cellule. La loro funzione è quella di produrre energia mediante un processo metabolico chiamato fosforilazione ossidativa(l’ossigeno respirato brucia zuccheri e grassi assorbiti con gli alimenti, producendo anidride carbonica ed energia sotto forma di ATP). Più del di 90% dell’energia necessaria per sostenere la vita e lo sviluppo viene prodotta dai mitocondri. Quando questa energia viene a mancare, per un alterato funzionamento mitocondriale, la vita della cellula stessa e conseguentemente, quella del nostro organismo sono a rischio. Le malattie mitocondriali sono molto variabili sul piano clinico, sia per quanto riguarda l’età di esordio sia per il tipo di evoluzione ed il tessuto coinvolto; sembrano danneggiare la maggior parte delle cellule del cervello, dei motoneuroni, del cuore, del fegato, dei muscoli scheletrici, del rene e degli apparati respiratori e dell’endocrino. Il genoma mitocondriale, di 37 geni, è meno “stabile” rispetto al genoma cromosomico, cioè è molto più suscettibile all’insorgenza di mutazioni, per la mancanza di involucro proteico e per la maggiore esposizione ai radicali liberi. I disturbi mitocondriale sono tutti disturbi metabolici. Ma, ci sono molti altri tipi di malattia metabolica che non coinvolgono i mitocondri.
Le Molecole dei processi respiratori, substrati, enzimi e transporters
PRODOTTI FONDAMENTALI DELLA CATENA DELLA RESPIRAZIONE MITOCONDRIALE: VIETATA LA CARENZA !
Piruvato,
NADH, (nicotinammide adenina dinucleotide)
Ubichinone (detto anche Coenzima Q) ,
Riboflavina (vitamina B2),
Acido folico (vitamina B9) ,
Tiamina (vitamina B1),
PL-Pufa (omega3),
Fe-S (ferro-zolfo),
Sali
Piruvato
 il prof. Ronald Stanko, dell’Università di Pittsburgh, ha pubblicato nel 1999 il libro “The Power of Pyruvate- The natural way to better health and well-being” (Il Potere del Piruvato, la via naturale verso un salute ed un benessere migliori).
il prof. Ronald Stanko, dell’Università di Pittsburgh, ha pubblicato nel 1999 il libro “The Power of Pyruvate- The natural way to better health and well-being” (Il Potere del Piruvato, la via naturale verso un salute ed un benessere migliori).
Direttamente contenuto in numerosi cibi, tra cui soprattutto le mele rosse, il vino rosso e certi tipi di formaggi.
Si presume che sia porprio questo uno dei principali motivi dell’effetto benefico delle mele e del primato di longevità dei francesi, che seguono una dieta non particolarmente sana ma abbondante appunto in formaggi e vino rosso.
 Il piruvato è la sostanza principale che può regolarmente entrare nei mitocondri: altre sostanze, prima di potervi accedere, devono prima essere trasformate in piruvato. Per esempio lo zucchero glucosio, con la sua forma esagonale, non può entrare nei mitocondri per produrvi energia se non è prima scomposto in piruvato (…un meccanismo questo che non funziona bene nei diabetici).
Il piruvato è la sostanza principale che può regolarmente entrare nei mitocondri: altre sostanze, prima di potervi accedere, devono prima essere trasformate in piruvato. Per esempio lo zucchero glucosio, con la sua forma esagonale, non può entrare nei mitocondri per produrvi energia se non è prima scomposto in piruvato (…un meccanismo questo che non funziona bene nei diabetici).
Oggi è molto usato in particolare per i suoi effetti anti-cataratta, contro le complicazioni diabetiche e i radicali liberi).
Ecco la lunga lista di effetti benefici che, nel libro del dr. Ronald Stanko, sono attribuiti al piruvato: smaltimento della massa grassa a favore di quella muscolare nel corso delle diete dimagranti e prevenzione del nuovo accumulo di grasso al termine della dieta, aumento delle capacità atletiche e della produzione d’energia, inibizione dei radicali liberi (il piruvato, anziché contrastare, come fanno gli altri antiossidanti, i radicali liberi già formati, avrebbe invece la capacità di prevenirne la formazione), effetto antitumorale, diminuzione del danno al cuore dopo un attacco cardiaco, diminuzione del colesterolo ed aumento dell’efficienza cardiaca, effetto antidiabetico e contro le complicazioni diabetiche, effetto antinfiammatorio.
NADH, cioè il nicotinammide adenina dinucleotide, è una biomolecola la cui funzione è quella di permettere le ossido riduzioni,  trasferendo elettroni. È un coenzima ossidoriduttivo. (NAD per indicare la forma ossidata e in NADH per la forma ridotta). Il NAD viene sintetizzato, nell’organismo, da tre diverse vie che coinvolgono, rispettivamente, l’acido nicotinico (ovvero la niacina o vitamina PP), la nicotinammide e l’acido chinolinico. Esistono in commercio diversi integratori di questa molecola, che francamente riteniamo poco utili. Sia l’acido nicotinico che la nicotinamide sono largamente presenti in natura: lievito, fegato, pesce, pollame e carni rosse, frutta secca e legumi forniscono la maggior parte della niacina alimentare. Oltre all’apporto dietetico di acido nicotinico e nicotinamide, il fabbisogno dell’organismo viene in parte soddisfatto a partire dal triptofano, un aminoacido precursore della niacina. Importanti fonti alimentari di triptofano sono la carne, il latte e le uova. In genere, l’assorbimento intestinale di acido nicotinico è molto buono.
trasferendo elettroni. È un coenzima ossidoriduttivo. (NAD per indicare la forma ossidata e in NADH per la forma ridotta). Il NAD viene sintetizzato, nell’organismo, da tre diverse vie che coinvolgono, rispettivamente, l’acido nicotinico (ovvero la niacina o vitamina PP), la nicotinammide e l’acido chinolinico. Esistono in commercio diversi integratori di questa molecola, che francamente riteniamo poco utili. Sia l’acido nicotinico che la nicotinamide sono largamente presenti in natura: lievito, fegato, pesce, pollame e carni rosse, frutta secca e legumi forniscono la maggior parte della niacina alimentare. Oltre all’apporto dietetico di acido nicotinico e nicotinamide, il fabbisogno dell’organismo viene in parte soddisfatto a partire dal triptofano, un aminoacido precursore della niacina. Importanti fonti alimentari di triptofano sono la carne, il latte e le uova. In genere, l’assorbimento intestinale di acido nicotinico è molto buono.
 Il NADH prodotto attraverso i vari processi redox cui presiede, trasferisce i suoi elettroni nella catena di fosforilazione ossidativa mitocondriale, nella quale il NAD viene riossidato, si genera ATP (adenosintrifosfato) e l’ossigeno, acquisendo ioni idrogeno, viene ridotto ad acqua. Il NADH quindi è essenziale per la produzione di ATP, la principale fonte energetica dell’organismo.
Il NADH prodotto attraverso i vari processi redox cui presiede, trasferisce i suoi elettroni nella catena di fosforilazione ossidativa mitocondriale, nella quale il NAD viene riossidato, si genera ATP (adenosintrifosfato) e l’ossigeno, acquisendo ioni idrogeno, viene ridotto ad acqua. Il NADH quindi è essenziale per la produzione di ATP, la principale fonte energetica dell’organismo.
Grazie all’azione antiossidante che combatte i radicali liberi, è necessaria un’ottimale apporto di NADH che produce benefici innumerevoli che spaziano dal rafforzamento del sistema immunitario, al miglioramento delle capacità cognitive, decisionali e mnemoniche, alla protezione dai danni cellulari indotti da agenti tossici (inquinamento, smog, composti chimici, luce ultravioletta). Inoltre, “poiché le alterazioni cellulari sono la causa biologica di un certo numero di malattie come il cancro,  l’artrite reumatoide, l’arteriosclerosi”, ne deriva che “più NADH abbiamo e più siamo protetti dal rischio che insorgano malattie degenerative”. Pensiamo poi alla stanchezza cronica, a tutte quelle persone che manifestano una sintomatologia similinfluenzale, mialgia, un lieve rialzo febbrile, linfoadenopatia e lievi disfunzioni cognitive (es. difficoltà di concentrazione), etc….
l’artrite reumatoide, l’arteriosclerosi”, ne deriva che “più NADH abbiamo e più siamo protetti dal rischio che insorgano malattie degenerative”. Pensiamo poi alla stanchezza cronica, a tutte quelle persone che manifestano una sintomatologia similinfluenzale, mialgia, un lieve rialzo febbrile, linfoadenopatia e lievi disfunzioni cognitive (es. difficoltà di concentrazione), etc….
Ecco perché tutti questi parametri sono i primi ad essere controllati e ad essere ristabiliti con le visite TLM. ( Vedi articolo ,Una visita “medica” speciale: la TLM (time listen methodology) presso i centri CANTICA (QantyQa) )
L’ Ubichinone (detto anche Coenzima Q) è presente in molti alimenti: arachidi, spinaci, oli vegetali, salmone, tonno, sardine, manzo. Per assorbire meglio il coenzima q10 è bene consumare cibi ricchi di grassi perché tale molecola è liposolubile. Quindi le fonti migliori sono i prodotti ricchi di grassi buoni come la frutta secca, gli oli vegetali e i pesci grassi come il salmone o il tonno. E’ per antonomasia il trasportatore di elettroni ( ed anche protoni) a livello dei complessi I, II e III della catena respiratoria nei mitocondri ed è particolarmente concentrato nel cuore nel muscolo striato e nel fegato. Il contenuto corporeo complessivo di ubichinone si calcola essere di circa 1.5 grammi. Con l’invecchiamento la sintesi naturale nel nostro  organismo di questa molecola, diminuisce. Inoltre, essendo sintetizzato a partire dalla tirosina con la partecipazione di vitamine del gruppo B (acido folico, niacina, riboflavina e piridossina), nella senescenza è estremamente facile avere carenze relative di queste vitamine e quindi sviluppare stati carenziali di ubichinone. Pertanto, nei pazienti anziani, in cui si consiglia spesso un’integrazione vitaminica, si dovrebbe consigliare anche l’integrazione di ubichinone. In generale, per gli scopi integrativi, è consigliata un’assunzione quotidiana di almeno 10 mg per mantenere le concentrazioni nel siero ai livelli ottimali di 0.7-1 μg/L, L’integrazione di ubichinone è obbligatoria da molti anni negli USA per tutti coloro che assumono statine, ovvero il medicinale più diffuso in Occidente noto anche come ” pastiglia per il colesterolo” (Anche se molti medici sono assolutamente contrari all’uso di questo farmaco, ritenuto più pericoloso dell’eccesso stesso di colesterolo). La prima sostanza che viene consumata dalle statine è proprio quest’enzima, determinandone la carenza cronica.
organismo di questa molecola, diminuisce. Inoltre, essendo sintetizzato a partire dalla tirosina con la partecipazione di vitamine del gruppo B (acido folico, niacina, riboflavina e piridossina), nella senescenza è estremamente facile avere carenze relative di queste vitamine e quindi sviluppare stati carenziali di ubichinone. Pertanto, nei pazienti anziani, in cui si consiglia spesso un’integrazione vitaminica, si dovrebbe consigliare anche l’integrazione di ubichinone. In generale, per gli scopi integrativi, è consigliata un’assunzione quotidiana di almeno 10 mg per mantenere le concentrazioni nel siero ai livelli ottimali di 0.7-1 μg/L, L’integrazione di ubichinone è obbligatoria da molti anni negli USA per tutti coloro che assumono statine, ovvero il medicinale più diffuso in Occidente noto anche come ” pastiglia per il colesterolo” (Anche se molti medici sono assolutamente contrari all’uso di questo farmaco, ritenuto più pericoloso dell’eccesso stesso di colesterolo). La prima sostanza che viene consumata dalle statine è proprio quest’enzima, determinandone la carenza cronica.

Riboflavina (vitamina B2) è disponibile soprattutto a livello di origine animale nelle interiora (Fegato bovino 3,3 mg/100g, bovino più del suino e più dell’equino; fegato più di rene e rene più di cuore), interiora più delle bistecche (0.5 mg), Latte di vacca concentrato come p.es. quello in polvere ( 1,8 mg), Tuorlo d’uovo 0,5 mg, Sgombro, Calamaro, Seppie, 0,4 mg, quindi a seguire i Formaggi dal Camembert al Feta greco, al caciocavallo, al Pecorino, all’Emmenthal, al Grana (0,36 mg), allo Yogurt (0,35 mg), etc.. Le carni bianche avicole seguono con valori ancora più bassi (attorno ai 0,35 mg). Mentre in ambito vegetale: Spirulina pura italiana in scaglie 3,65 mg, Lievito di birra secco 2,65 mg, Funghi secchi e Peperoncino secco 1,27, Mandorle e Cioccolato attorno a valori di 1 mg, Pappa reale 0,75, Germe di frumento 0,61, Radicchio verde 0,53, Soia secca 0,52, Grano saraceno, Alghe varie e Fette biscottate 0,4 mg. Succo d’uva 0,35 mg, Pane fatto in casa, Quinoa, Verdure a foglie verdi , Broccoli 0,35 mg, diversi tipi di semi e Cereali integrali 0,30 mg, Barbabietole cotte 0.29 mg, Fagioli freschi 0.22 mg.
Si distrugge se associata al bicarbonato di sodio ed il suo assorbimento è ridotto anche dal consumo di alcolici, di tabacco, di zucchero in eccesso e dal caffè. Da ricordare che anche i contraccettivi orali possono indurre una carenza di vitamina B2.
 Acido folico (vitamina B9) è disponibile soprattutto a livello di origine animale nelle interiora (Fegato 500 mcg/100g ), che però non sono alimenti di uso né comune né quotidiano, pertanto per mantenere costante l’assunzione della vitamina B9 è consigliato aumentare l’apporto di verdura fresca, frutta, legumi, cereali integrali e anche frutta secca: asparagi, broccoli, carciofi, cavoletti di Bruxelles, cavolfiori e cereali integrali contengono circa 150-200 mcg di acido folico ogni 100 g; arance, clementine, mandarini, avocado, bieta costa, fagioli, ceci, lenticchie, piselli, kiwi, indivia belga, lattuga, noci, mandorle, nocciole, pistacchi, pane e pasta integrali, rucola e spinaci forniscono 50-80 mcg. Anche le uova sono una buona fonte di vitamina B9: un uovo ne contiene 30 microgrammi.
Acido folico (vitamina B9) è disponibile soprattutto a livello di origine animale nelle interiora (Fegato 500 mcg/100g ), che però non sono alimenti di uso né comune né quotidiano, pertanto per mantenere costante l’assunzione della vitamina B9 è consigliato aumentare l’apporto di verdura fresca, frutta, legumi, cereali integrali e anche frutta secca: asparagi, broccoli, carciofi, cavoletti di Bruxelles, cavolfiori e cereali integrali contengono circa 150-200 mcg di acido folico ogni 100 g; arance, clementine, mandarini, avocado, bieta costa, fagioli, ceci, lenticchie, piselli, kiwi, indivia belga, lattuga, noci, mandorle, nocciole, pistacchi, pane e pasta integrali, rucola e spinaci forniscono 50-80 mcg. Anche le uova sono una buona fonte di vitamina B9: un uovo ne contiene 30 microgrammi.
Frutta e ortaggi andrebbero mangiati preferibilmente freschi e crudi: la cottura distrugge almeno il 50% dell’acido folico. La luce solare e una prolungata conservazione sono altri due fattori che contribuiscono a impoverire l’alimento di folato.

Tiamina (vitamina B1). La disponibilità è molto simile a quella descritta per la B2 con la carne di maiale tra le fonti principali di origine animale seguita dai tuorli d’uova ed in primis la Spirulina pura italiana (3 mg) , pappa reale, lievito di birra, mandorle e nocciole e noci, legumi, riso intero, ortaggi di colore verde, patate tra le fonti principali di origine vegetale. Il Germe di grano ne contiene quasi il triplo della soia secca (2,44 mg contro 0,95 mg). Tra i semi prevale il sesamo con 0,79 mg. Tra le farine prevale quella di aveva con 0,69 mg, mentre i biscotti secchi ne hanno il doppio 1,4 mg. Tra I legumi prevalgono le lenticchie con 0,87 mg. Tra le carni prevale il prosciutto crudo 1,8 mg e le lombate di maiale a 1 mg. Il salmone affumicato è a 0.5 mg. Tra la frutta secca noci di macadamia e pistacchi si assestano sull’1 mg.
PL-Pufa (Acidi Grassi Polinsaturi ed in particolare gli omega3). Tutta la frutta secca contiene una buona concentrazione di entrambi i precursori della serie omega3 e omega6, in particolare le noci hanno il miglior rapporto omega6:omega3. E’ noto inoltre che i semi di lino (da consumarsi macinati, oppure in forma di olio, ma solo se l’olio viene prodotto e commercializzato rispettando la catena del freddo) sono ottime fonti di ALA (Acido Alfa Linolenico precursore dell’omega3) Da questo precursore la trasformazione in EPA (l’omega3 in forma matura) è del 5-10% negli uomini sani e la conversione in DHA è del 2-5%. Per quanto riguarda le molecole in forma matura, vi sono solo due fonti: il pesce “grasso” e le alghe. Perché i pesci sono ricchi di omega3 e come fanno gli animali onnivori a raggiungere una buona quota alimentare di PUFA maturi? Tutto dipende dal sistema della catena alimentare in cui un organismo funge da serbatoio per quello successivo. I pesci non sono molto più efficienti di noi nel sintetizzare dai precursori ma semplicemente ottengono gli acidi grassi essenziali già preformati (vale a dire in quella che abbiamo chiamato la “forma matura”) attraverso l’alimentazione e precisamente dalle alghe marine.
Fe-S (ferro-zolfo). Le proteine ferro-zolfo contengono ferro associato ad atomi di zolfo [FeS]. Gli atomi di zolfo possono essere residui di cisteina o zolfo inorganico. Le proteine ferro-zolfo possono avere strutture semplici (un solo atomo di ferro) o complesse (da due a quattro atomi di ferro). Nelle proteine ferro-zolfo di Rieske, un tipo particolare di proteina ferro-zolfo, l’atomo di ferro è coordinato con 2 residui di istidina invece che con 2 residui di cisteina. Nelle proteine ferro-zolfo l’atomo di ferro può assumere stati di ossidazione Fe2+ o Fe3+.
Le proteine Fe-S trasportano elettroni.

Il ferro si trova nei cibi sotto forma di ferro eme o di ferro non eme (quest’ultimo è detto anche ferro inorganico). Nel secondo caso, può essere presente o sotto forma di ione ferroso (ione Fe2+, bivalente), o sotto forma di ione ferrico (ione Fe3+, trivalente), i quali sono solubili rispettivamente a pH 7 e a pH minore di 3.
Il ferro eme si trova solo negli alimenti di origine animale, in particolare nella carne, in quanto presente nelle emoproteine muscolari (i latticini, al contrario, ne sono del tutto privi). Ha la possibilità di essere maggiormente assorbito rispetto al ferro non eme, ed è presente in quantità minore.
Il ferro non eme si trova sia nella carne, sia negli alimenti di origine vegetale. Tra gli alimenti più ricchi di ferro ci sono il tuorlo d’uovo, i legumi, il fegato, le carni rosse, le vongole. Gli spinaci, seppur contengano ferro, non costituiscono un buona fonte (a differenza di quanto affermano le credenze popolari) perché il ferro è legato all’ossalato che lo rende non assorbibile dal corpo umano e al fitato (l’inositolo esafosfato), che ne inibisce la dissociazione ad opera delle reazioni chimiche gastrointestinali, e quindi l’assorbimento. Gli alimenti ricchi di ferro vengono attaccati all’interno dello stomaco dai succhi gastrici, che facilitano la dissociazione degli ioni del ferro dal resto del cibo (dissociazione che è peraltro favorita dalla cottura). Con l’aiuto dell’acido ascorbico, tali ioni vengono subito ridotti a ioni ferrosi Fe2+; è per questa ragione che per assorbire meglio il ferro presente nei vegetali è consigliabile il consumo contemporaneo di alimenti ricchi di vitamina C. L’assorbimento aumenta fino a 2-3 volte.
Sali ovvero gli elementi minerali sempre fisiologicamente presenti nel sangue e nei tessuti dell’organismo in particolare i primi 12: Fluoruro di calcio, Fosfato di calcio, Solfato di calcio, Fosfato di ferro, Cloruro di potassio, Fosfato di potassio, Solfato di potassio, Fosfato di magnesio, Cloruro di sodio, Fosfato di sodio, Solfato di sodio, Biossido di silicio.
Informazioni tecniche per i nostri corsisti master:( ricordate che “il prosciutto omeopatico” non funziona! Il grosso del lavoro nei casi raffinati, già caduti in situazioni patologiche gravi, è da fare nella materia: quindi bisogna lavorare anche nella biochimica, non solo sulla parte psichica o spirituale!…senza nulla togliere alla preminenza dello spirituale ed alle sue velocità.):
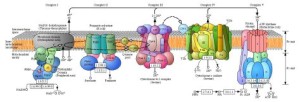
I COMPLESSI PROTEICI DELLA MEMBRANA INTERNA MITOCONDRIALE
La catena respiratoria comprende 3 complessi proteici inseriti nella membrana mitocondriale interna (complessi I, III e IV) e molecole di trasferimento mobili, quali il coenzima Q e il citocromo-c:
• complesso I: NADH deidrogenasi
• complesso III: citocromo-c reduttasi
• complesso IV: citocromo-c ossidasi
Il complesso II è la succinato deidrogenasi, è l’unico enzima presente del ciclo dell’acido citrico presente nella membrana interna mitocondriale. Il complesso V, l’ATP sintasi, non partecipa al trasferimento di elettroni.
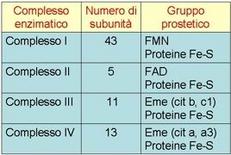
Tutti i complessi della catena respiratoria sono formati da numerose subunità polipeptidiche e contengono una serie di coenzimi redox legati alle proteine:
• Flavine (LE VITAMINE B!!) : FMN e FAD (FAD=FADH2) nei complessi I e II
• Coenziima Q
• Centri Ferro-Zolfo: complessi I, II e III
• Gruppi eme: II, III e IV
I trasportatori flavinici e il CoQ sono trasportatori misti : trasportano elettroni e H+
I centri Ferro-Zolfo e i gruppi eme dei citocromi sono trasportatori puri: trasportano elettroni
I citocromi rappresentano l’ultima classe di componenti che partecipano al trasporto degli elettroni.
•I citocromi sono delle proteine contenenti eme.
•L’eme è la ferro-porfirina che si trova nelle emoglobine e nella mioglobina. I citocromi del tipo a, b e c sono le principali varianti di queste proteine presenti nelle cellule.
•Ciascun citocromo è costituito da una catena polipeptidica e da un gruppo eme specifico.
•Il ferro presente nei citocromi, ma non quello nell’emoglobina, subisce delle ossido-riduzioni fisiologiche passando dallo stato ferroso (2+) a quello ferrico (3+) e viceversa
 L’ossidazione del NADH e del FADH2 viene compiuta dalla catena di trasporto degli elettroni, un insieme di complessi proteici contenenti centri redox caratterizzati da affinità per gli elettroni progressivamente crescenti. Gli elettroni viaggiano lungo questa catena partendo da potenziali di riduzione standard più bassi verso potenziali più alti.
L’ossidazione del NADH e del FADH2 viene compiuta dalla catena di trasporto degli elettroni, un insieme di complessi proteici contenenti centri redox caratterizzati da affinità per gli elettroni progressivamente crescenti. Gli elettroni viaggiano lungo questa catena partendo da potenziali di riduzione standard più bassi verso potenziali più alti.
Gli elettroni vengono trasportati dai Complessi I e II al Complesso III mediante il CoQ, e dal complesso III al Complesso IV attraverso la proteina periferica di membrana citocromo c
COMPLESSO I
Il complesso I o NADH-coenzima Q Ossidoreduttasi (NADH deidrogenasi) catalizza l’ossidazione del NADH da parte del CoQ. E’ il più grosso, complesso contenente 43 catene polipeptidiche. Contiene una molecola di FMN e sei o sette centri ferro-zolfo che partecipano al trasporto degli elettroni.
NADH + CoQ (ossidato) NAD+ + CoQ (ridotto)c
I trasportatori di elettroni sono organizzati in quattro complessi multienzimatici posizionati in maniera ordinata sulla membrana mitocondriale interna. L’affinità per gli elettroni aumenta dal complesso I fino all’ossigeno.
Ogni complesso è caratterizzato da una propria composizione in proteine e dalla presenza di determinati gruppi prostetici.
Il complesso I (NADH-coenzima Q ossido reduttasi) è costituito da diverse proteine Fe-S e da una flavo proteina contenente FMN.
Questo complesso riceve gli elettroni dal NADH, prodotto durante le reazioni cataboliche, e li cede al coenzima Q.
Il percorso degli elettroni è:
NADH → flavoproteina → proteine Fe-S → coenzima Q.
Al coenzima Q arrivano anche i 2 protoni (del NADH e H+).
Il coenzima Q ridotto (QH2) diffonde nella membrana mitocondriale interna verso il complesso III.
Il trasferimento di elettroni porta contemporaneamente alla fuoriuscita dalla matrice verso lo spazio intermembrana di protoni (H+).
COMPLESSO II
Il complesso II (succinato ubichinone ossido-reduttasi) catalizza l’ossidazione del FADH2 da parte del CoQ
FADH2 + CoQ10 FAD + CoQ10H2
I suoi centri redox comprendono il FAD legato covalentemente alla succinato deidrogenasi, sul quale passano inizialmente gli elettroni , un centro 4Fe-4S, due centri 2Fe-2S e un citocromo b560
IL complesso II (succinato-coenzima Q ossido reduttasi) è di piccole dimensioni e non attraversa completamente la membrana mitocondriale interna. E’ costituto dall’enzima succinato deidrogenasi del ciclo acido citrico (ossidazione del succinato a fumarato), il cui coenzima è il FAD, da proteine FeS e da un citocromo di tipo b.
Il percorso degli elettroni è:
Succinato → FAD → proteine Fe-S → coenzima Q
Al coenzima Q, oltre che dai complessi I e II, arrivano anche gli elettroni provenienti da altre deidrogenasi, come la acil CoA deidrogenasi (FAD dipendente) della β-ossidazione degli acidi grassi e la glicerolo-3-fosfato deidrogenasi, enzima implicato nel sistema navetta utilizzato per traslocare il NADH citosolico all’interno della matrice mitocondriale.
Il coenzima Q ridotto risultante da tutte queste reazioni diffonde nella membrana mitocondriale interna verso il complesso III.
COMPLESSO III
Il complesso III catalizza l’ossidazione del CoQH2 da parte del citocromo c
Tale complesso funziona per consentire a una molecola di CoQH2 , un trasportatore a due elettroni, di ridurre due molecole di citocromo c, un trasportatore a un elettrone.
Questo complesso contiene due citocromi b, un citocromo c1 e un centro 2Fe-2S (centro di Rieske) al quale è legata la proteina ferro zolfo detta ISP.
Il complesso III, detto Coenzima Q citocromo c ossido reduttasi, è costituto da proteine FeS, citocromo b (cit bH, cit bL), citocromo c1. Il complesso III riceve gli elettroni dal coenzima Q e li trasferisce al citocromo c.
Il percorso degli elettroni è:
coenzima Q → proteine FeS → cit c1 → cit c
Il citocromo c non fa parte del complesso III ma si muove lungo la membrana mitocondriale interna verso il complesso IV.
Il complesso III è un altro sito dove i protoni fuoriescono dalla matrice.
COMPLESSO IV
Il complesso IV (citocromo c-ossidasi) catalizza l’ossidazione del citocromo c ridotto da parte dell’O2, l’accettore terminale degli elettroni nel processo di trasporto degli elettroni.
Il complesso IV (citocromo c ossidasi) è costituto da proteine rame-zolfo (CuA, CuB), citocromo a, citocromo a3.
Il complesso IV riceve gli elettroni dal citocromo c e li trasferisce all’ossigeno che si riduce ad H2O.
Il percorso degli elettroni è:
Cit c → CuA → cit a → cit a3 → CuB → O2
Al trasferimento degli elettroni si associa la fuoriuscita di protoni (H+) dalla matrice verso lo spazio intermembrana.
Alcuni esempi di applicazioni pratiche:
VITILIGINE
Distruzione dei Melanociti ad opera della dopamina che genera dopaminochrome, quindi perossido di idrogeno che reagendo con Fe genera OH° radicali ossidrilici. Il processo si attiva dove sono i recettori per la dopamina espressi a livello elevato rispetto al normale.
FIBROMIALGIA
E’ un dolore muscolare diffuso caratterizzato dalla presenza di noduli fibromialgici definiti trigger points; ossia dei punti dolorosi al tatto. Secondo una valente teoria sarebbero causati dall’invasione dei muscoli ad opera della trichina (un parassita) secondaria ad inibizione del sistema immunitario per somatizzazione di eventi con proiezione sulle aree coinvolte (corticale motorio).
FATICA CRONICA
Disfunzione mitocondriale seria carenziale per la presenza di parassiti nell’intestino tenue ed eccesso di neuropeptidi inibitori. Accumulo di sostanze organiche tossiche come ammoniaca ed omocisteina. Presenza di Metalli a livello epatico, intestinale, cerebrale.
A parte i deficit carenziali dietetici, la generazione del blocco metabolico mitocondriale può essere la somma di più conflitti DHS, con aumento dei neuropeptidi eccitatori come l’adrenalina e dopamina in primis, CRH, ADH, colinesterasi e serotonina poi.
A sua volta sarebbe generato una sorta di cortocircuito responsabile del mantenimento del processo….(generazione di carbonili derivati da proteine e zuccheri) una sorta di “volano metabolico”…che porterebbe appunto all’accumulo di sostanze tossiche difficili da smaltire con esaurimento di alcuni trasportatori come la ceruloplasmina con impoverimento del Selenio, glutatione etc.
TACHICARDIA ED IPERTENSIONE
Attivazione di neuroni eccitatori nell’area funzionale del Simpatico, tronco encefalico e nuclei della base, con emissione continua di adrenalina, acetilcolina, glutammato. Espressione abnorme di recettori per le sostanze di cui sopra nelle cellule dell’organo bersaglio simbolico.
RISCHIO CARDIACO ( ICTUS. INFARTO, ISCHEMIA…)
Tipico del Pz. in uscita da conflitto di territorio; valutabile quest’ultima fase mediante dosaggio dell’ l’interferone alfa e gamma.
Importanti i markers dell’ischemia come: Troponin-1, S-100, CPK mb. Glutatione-S-Trasferasi serve invece a valutare lo spessore della placca vascolare (presenza di arteriosclerosi). Le Proteina C reattiva, Acido Lattico, ammoniaca e sali tessutali sono utili per valutare problematiche carenziali e blocchi metabolici nella produzione di ATP.
CEFALEA
Determinata da alterazioni del flusso ematico cerebrale e arterioso dello scalpo e dalla depressione della diffusione elettrica corticale (alterazione fondamentale nella corteccia cerebrale che consiste in un picco di iperpolarizzazione seguito dalla depolarizzazione). L’attivazione di aree specifiche cerebrali da parte di conflitti causano a sua volta l’ aumento del cortisolo, testosterone, estradiolo e progesterone capaci d’indurre un’infiammazione neurogena, con vasodilatazione, attivazione dei globuli bianchi e permeabilità dei capillari. L’infiammazione conduce all’irritazione delle fibre sensitive trigeminali perivascolari. Ne consegue una cascata di fenomeni, che causano le alterazioni nel flusso ematico e la forte cefalea. Lo spegnimento del conflitto ed il ripristino di eventuali carenze metaboliche mitocondriali porterebbero alla risoluzione della cefalea. l’ATP deve essere alta per consentire la disattivazione del neurone ove risiede il conflitto.
Leggi anche sullo stesso argomento:
Il recupero della produzione mitocondriale di ATP è una delle attIvità primarie delle terapie a seguito delle visite TLM:
Una visita “medica” speciale: la TLM (time listen methodology) presso i centri CANTICA (QantyQa)
1. bis La Visita Medica TLM: 1bis. Un esempio pratico sui meccanismi indagati con la visita TLM
5.La Visita Medica TLM: L’analisi dei dati nutrizionali da accompagnare alla terapia
6. La Visita Medica TLM: L’analisi del dialogo interiore
Una visita “medica” speciale: la CANTICA (QantyQa)
Visione Olonomica del Cervello e Visita Cantica (QantyQa)
Storia di una Guarigione (vera) dall’emicrania
Storia di una Guarigione (vera) dalla psoriasi
Storia di una Guarigione (vera) dalla fibromialgia
Storia di una Guarigione (vera) dal tumore al seno
Cantica (QANTYQA) I PRIMI CENTRI BIOFISICI : INNOVAZIONE A COSTI SOCIALI PER IL DIRITTO ALLA SALUTE
Medicina sociale & Movimento Sereno. “La salute, il bene primario. Come riuscire a tutelarla oggi?”


